Wetenschappelijke publicatie
Eind 2019 werd de wereld overweldigd door COVID-19, veroorzaakt door het SARS-CoV-2 virus. Nazorgtrajecten voor ziekenhuispatiënten moesten in korte tijd worden ingericht, op basis van expert opinion. Om deze nazorg door te kunnen ontwikkelen voor COVID-19 en (toekomstige) vergelijkbare infectieziekten, is evaluatie van het herstel in de verschillende nazorgtrajecten noodzakelijk. Dit artikel beschrijft de belangrijkste bevindingen van het CO-FLOW onderzoek tot op 12 maanden na ziekenhuisontslag.
Auteurs
DRS. L.M. (MARTINE) BEK
Klinisch epidemioloog, promovendus, afdeling Revalidatiegeneeskunde, Erasmus MC, Rotterdam
DRS. J.C. (JULIA) BERENTSCHOT
Bewegingswetenschapper, promovendus, afdeling Longgeneeskunde, Erasmus MC, Rotterdam
DR. M.H. (MAJANKA) HEIJENBROK-KAL
Klinisch epidemioloog, universitair docent, afdeling Revalidatiegeneeskunde, Erasmus MC, Rotterdam
DR. M.E. (MEREL) HELLEMONS
Longarts, afdeling Longgeneeskunde, Erasmus MC, Rotterdam
PROF. DR. J.G.J.V (JOACHIM) AERTS
Longarts, hoogleraar en hoofd afdeling Longgeneeskunde, Erasmus MC, Rotterdam
PROF. DR. G.M. (GERARD) RIBBERS
Revalidatiearts, hoogleraar en hoofd afdeling Revalidatiegeneeskunde, Erasmus MC, Rotterdam
DR. H.J.G. (RITA) VAN DEN BERG-EMONS
Bewegingswetenschapper, universitair hoofddocent, afdeling Revalidatiegeneeskunde, Erasmus MC,
Rotterdam
Eind 2019 werd de wereld overweldigd door COVID-19, een nieuwe infectieziekte die wordt veroorzaakt door het SARS-CoV-2-virus. Het klinische spectrum van COVID-19 varieert van een asymptomatische infectie tot critical illness die leidt tot intensive care (IC) opname.1 Naar schatting werd 3-4% van de mensen met COVID-19 opgenomen in het ziekenhuis,2,3 waarvan 15% op de IC.4
Nazorgtrajecten voor deze ziekenhuispatiënten moesten in het begin van de pandemie in korte tijd worden ingericht, op basis van expert opinion. Om deze nazorg te evalueren en om de langetermijngevolgen in kaart te brengen, is in de regio Rotterdam-Rijnmond-Delft in de zomer van 2020 het CO-FLOW onderzoek gestart: ‘COvid-19 Follow-up care paths and Long-term Outcomes Within the Dutch health care system, a combined rehabilitation, pulmonary, and intensive care perspective’.5 In dit onderzoek, waarin we vanuit Erasmus MC samenwerken met Rijndam Revalidatie, zorginstellingen Laurens en Aafje, en zes perifere ziekenhuizen (Albert Schweitzer, Franciscus Gasthuis & Vlietland, IJsselland, Ikazia, Maasstad en Reinier de Graaf Gasthuis), volgen we patiënten met COVID-19 door middel van fysieke en cognitieve testen en vragenlijsten tot op twee jaar na ziekenhuisontslag. Het uiteindelijke doel van CO-FLOW is om de nazorg voor COVID-19 en vergelijkbare (toekomstige) infectieziekten door te ontwikkelen, onder andere door systematische evaluatie van het herstel in de verschillende nazorgtrajecten: geen revalidatie, eerstelijns revalidatie, medisch specialistische revalidatie (MSR, klinisch en poliklinisch) en geriatrische revalidatiezorg (GRZ, klinisch).
Recent zijn drie CO-FLOW artikelen internationaal gepubliceerd. Hierin worden tussentijdse resultaten beschreven ten aanzien van het beloop van aanhoudende klachten6 en het fysieke,7 cognitieve en psychische herstel8 in de verschillende nazorgtrajecten tot 12 maanden na ziekenhuisontslag. In dit artikel presenteren we de belangrijkste bevindingen.
Design en populatie
Het CO-FLOW onderzoek, goedgekeurd door de Medisch Ethische Toetsingscommissie van Erasmus MC (MEC-2020-0487), is een prospectief multicenter cohortonderzoek bij volwassenen (≥18 jaar) die in een ziekenhuis in de regio Rotterdam-Rijnmond-Delft opgenomen zijn geweest voor COVID-19.6 Fysieke en cognitieve testen en interviews werden in het ziekenhuis, (geriatrisch) revalidatiecentrum of bij de patiënten thuis afgenomen op drie, zes, 12, en 24 maanden na ziekenhuisontslag; vragenlijsten werden op dezelfde meetmomenten via e-mail of post verstuurd en thuis ingevuld. Demografische en klinische kenmerken tijdens ziekenhuisopname werden retrospectief verzameld uit elektronische patiëntendossiers. Inclusie vond plaats tussen juli 2020 en oktober 2021.
Uitkomstmaten
Zelfgerapporteerde klachten
We hebben een Corona Symptom Checklist ontwikkeld op basis van de eerste ervaringen met patiënten met COVID-19,6 waarin gevraagd wordt naar de aanwezigheid van nieuwe of verergerde klachten (ja/nee) na infectie. Aanvullend werd vermoeidheid uitgevraagd met de Fatigue Assessment Scale (FAS), een score ≥22 indiceert substantiële vermoeidheid.9
Fysieke status
Cardiorespiratoire fitheid werd primair gemeten met de 6-minuten wandeltest (6MWT, in meters en als percentage van normwaarden)10 en secundair met de 1-minuut zit-naar-stand test (one-minute-sit-to-stand test, 1MSTST, in aantal herhalingen en als percentage van normwaarden).11 Algehele spierkracht werd geschat door meting van de maximale isometrische handknijpkracht (handgrip strength, HGS, in kg en als percentage van normwaarden).12 Normering is op basis van leeftijd en geslacht en, indien van toepassing, lengte en gewicht.
Cognitieve status
Cognitief functioneren werd gescreend met de Montreal Cognitive Assessment (MoCA, een score <26 indiceert lichte cognitieve stoornissen).13 De MoCA werd alleen herhaald bij patiënten met cognitieve stoornissen; hierbij werd steeds een andere MoCA-versie gebruikt om een leereffect te voorkomen. Subjectieve cognitieve klachten werden gemeten met de Cognitive Failures Questionnaire (CFQ, een score >43 indiceert cognitieve klachten).14
Psychische status
Posttraumatische stressstoornis (PTSS) werd gemeten met de Impact of Event Scale-Revised (IES-R, een score ≥33 indiceert symptomen van PTSS)15 en angst en depressie met de Hospital Anxiety and Depression Scale (HADS, een score ≥11 indiceert symptomen van depressie of angst).16
Data-analyse
Generalized estimating equations (GEE) analyse met herhaalde metingen werd gebruikt om het beloop over tijd in het totale cohort te analyseren voor zelfgerapporteerde klachten, en het fysiek, cognitief en psychisch herstel. GEE werd ook gebruikt om het herstel binnen de verschillende nazorgtrajecten te vergelijken over de verschillende meetmomenten, gecorrigeerd voor demografische en klinische kenmerken die significant verschillend waren tussen de nazorggroepen. Er werd een ongestructureerde covariantie matrix en een significantieniveau van p<0,05 gehanteerd. Voor de interim-analyses met betrekking tot zelfgerapporteerde klachten zijn data van 492 patiënten geanalyseerd, voor fysiek herstel 582 en voor cognitief/psychisch herstel 617.
Resultaten
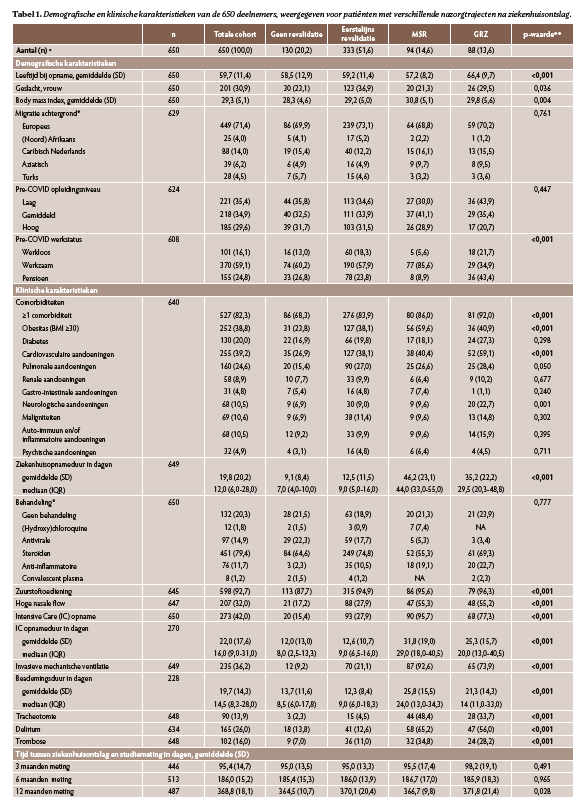
In totaal werden 650 patiënten geïncludeerd die tussen maart 2020 en juni 2021 uit het ziekenhuis werden ontslagen (tabel 1). In totaal startten 333 patiënten (51%) na ziekenhuisontslag met eerstelijns revalidatiezorg, voornamelijk fysiotherapie, 94 (15%) met MSR, waarvan 18 (19%) alleen poliklinisch, 88 (14%) met GRZ en 130 (20%) patiënten gingen naar huis zonder revalidatiezorg (n=5: nazorg onbekend). De mediaan (interkwartielafstand) revalidatieduur voor MSR was 32,0 (26,0-43,5) en voor GRZ 35,0 (21,0-41,7) dagen.
Patiënten die werden getriageerd naar MSR of GRZ hadden een ernstiger ziektebeloop, veelal gekenmerkt door IC-opname, langere opnameduur en vaker optreden van delirium of trombose in vergelijking met de andere groepen (p<0,001). Daarbij waren patiënten in GRZ gemiddeld ouder en vaker met pensioen, en hadden meer comorbiditeiten, waaronder diabetes en cardiovasculaire aandoeningen (p<0,001). Patiënten in MSR waren gemiddeld jonger, hadden bijna allemaal betaald werk, en hadden vaker obesitas.

Zelfgerapporteerde klachten
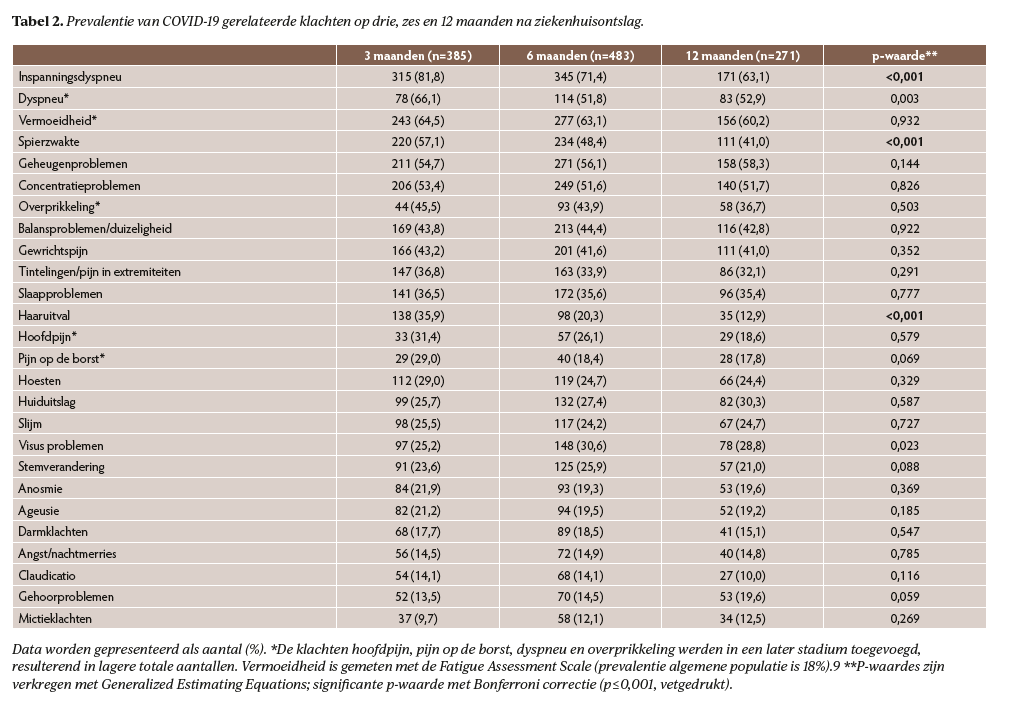
Op drie maanden na ziekenhuisontslag had 97% van de patiënten ≥1 klacht, dit verminderde tot 92% op 12 maanden (p=0,01). Op alle meetmomenten waren de meest voorkomende klachten (inspannings)dyspnoe, vermoeidheid, spierzwakte en geheugen- en concentratieproblemen (tabel 2). Vermoeidheid verbeterde niet over de tijd, op 12 maanden rapporteerde 60% van de patiënten vermoeidheid. Klachten die over de tijd significant verbeterden waren inspanningsdyspnoe, spierzwakte en haaruitval (p<0,001).
Fysieke status
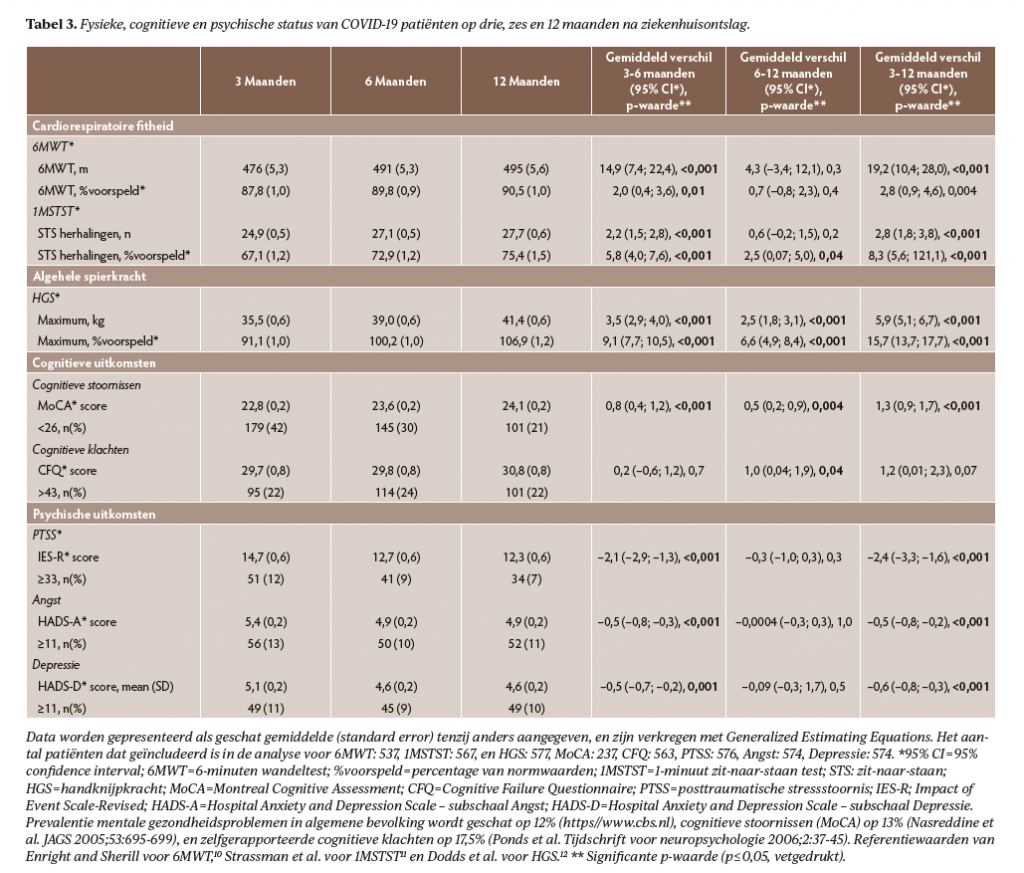
In het totale cohort (tabel 3) verbeterden patiënten (p<0,001) op de 6MWT (+14,9 meter [95% CI 7,4-22,4], 1MSTST (+2,2 herhalingen [1,5-2,8]) en HGS (+3,5 kg [2,9-4,0]) tussen drie en zes maanden en op HGS ook tussen zes en 12 maanden (+2,5 kg [1,8-3,1]).
Alleen patiënten in de eerste lijn en MSR (figuur 1) verbeterden significant tussen drie en zes maanden op zowel 6MWT (p<0,05) als 1MSTST (p<0,001), patiënten in GRZ verbeterden in die periode alleen op 1MSTST (p=0,002). Patiënten zonder revalidatienazorg lieten geen significante verbeteringen op deze testen zien. Alle nazorggroepen lieten significante verbeteringen zien op HGS tussen drie en zes maanden (p<0,001) en tussen zes en 12 maanden (p<0,01).
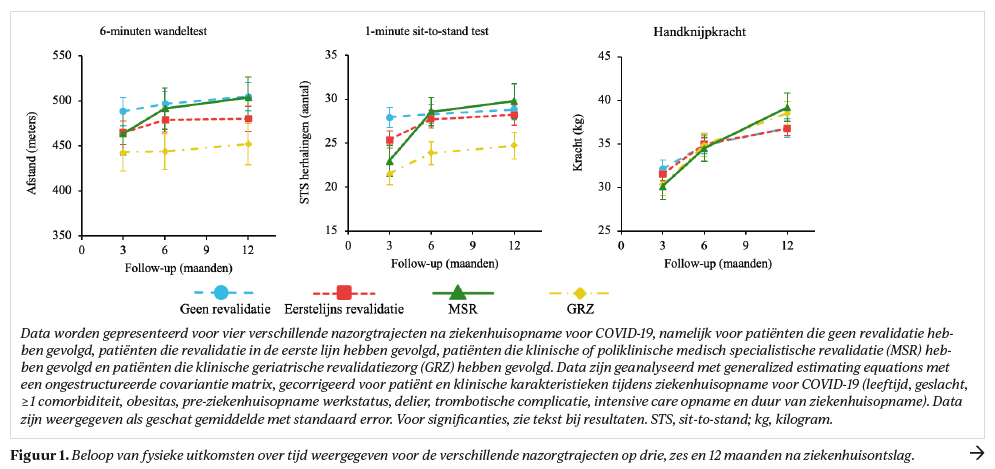
Op drie maanden verschilde het percentage van normwaarden dat bereikt werd in 1MSTST significant (p<0,001) tussen de verschillende nazorgtrajecten, met de grootste beperkingen in MSR en GRZ groepen (figuur 2). Op 12 maanden waren er geen significante verschillen meer tussen de verschillende nazorgtrajecten en bereikten patiënten in het totale cohort gemiddeld 91% van normwaarden op 6MWT, 75% op 1MSTST, en 107% op HGS (tabel 3).
Cognitieve en psychische status
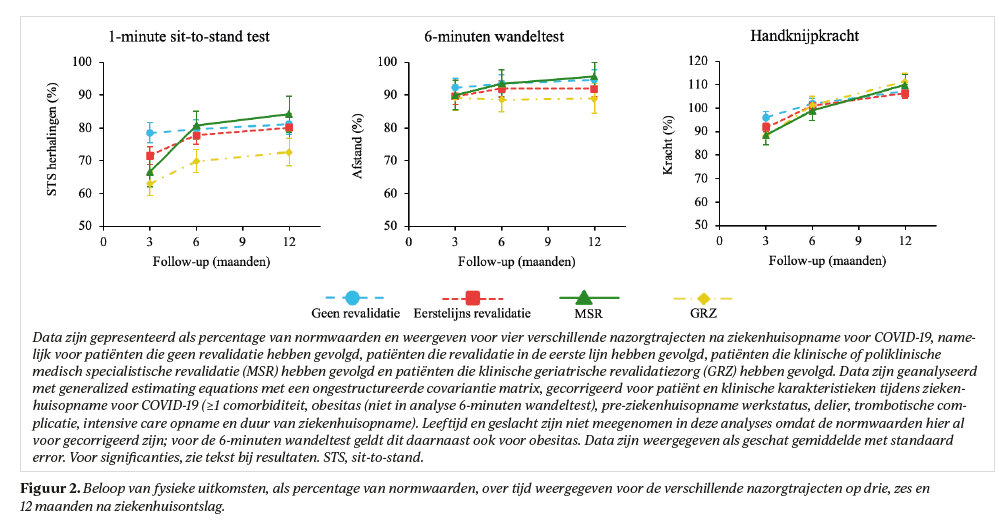
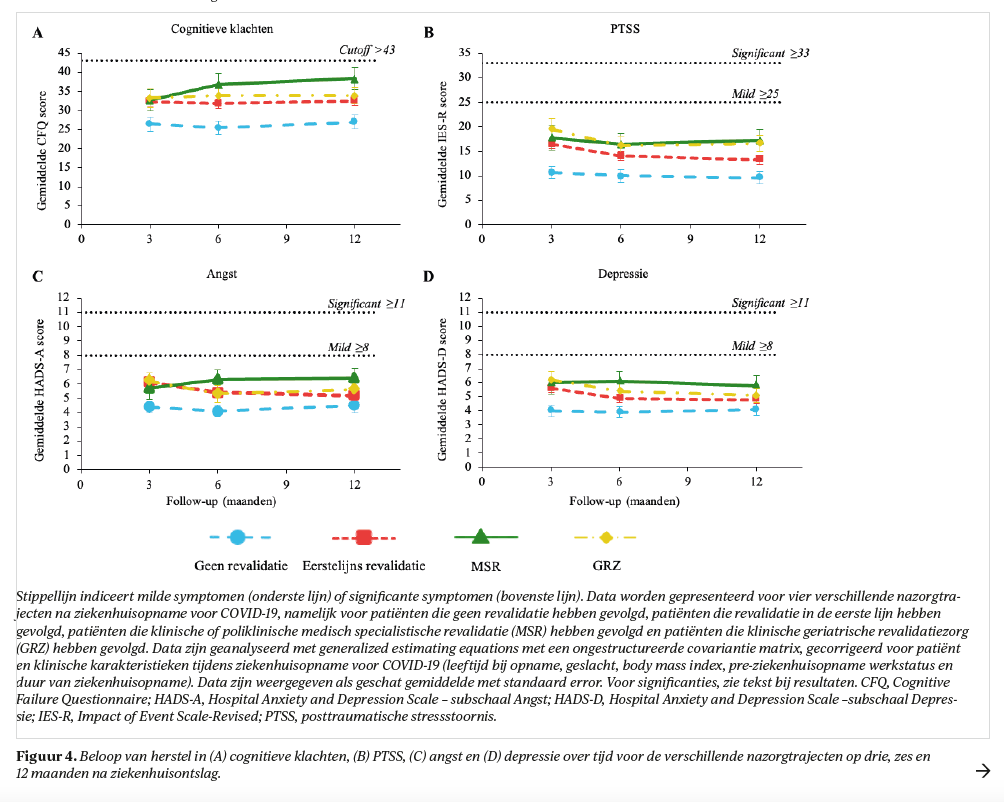
In het totale cohort (tabel 3) verbeterden patiënten in het jaar na ziekenhuisontslag (p<0,001) op cognitieve stoornissen (+1,3 [0,9-1,7]), PTSS (−2,4 [−3,3- −1,6]), angst (−0,5 [−0,8- −0,2]) en depressie (−0,6 [−0,8- −0,3]), maar niet op cognitieve klachten (p=0,07). Op 12 maanden had 21% lichte cognitieve stoornissen, 22% cognitieve klachten, 7% PTSS, 11% angst en 10% depressieve klachten. Patiënten zonder revalidatienazorg ervaarden het minst vaak cognitieve en psychische klachten.
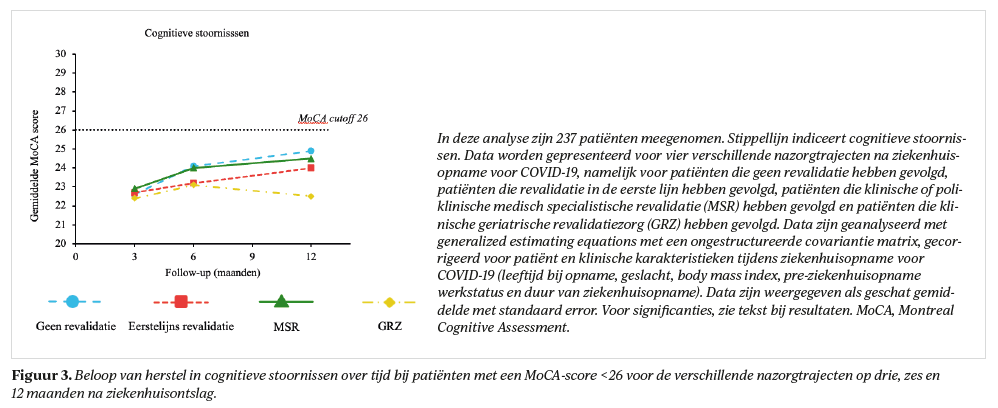
Alle nazorggroepen, behalve GRZ, verbeterden over de tijd in cognitieve stoornissen (p<0,03, figuur 3); patiënten in GRZ toonden het vaakst cognitieve stoornissen. Patiënten in de eerste lijn verbeterden significant op psychische klachten tussen drie en zes maanden (p<0,001, figuur 4). De MSR groep liet een significante verslechtering zien op cognitieve klachten (p=0,001) tussen drie (14%) en zes maanden (28%), ook had deze groep de hoogste prevalentie voor psychische klachten op 12 maanden (15% PTSS, 16% angst en depressieve klachten). Cognitieve klachten waren op 12 maanden gecorreleerd (r:0,559-0,728, p<0,001) met psychische klachten, maar niet met cognitieve stoornissen (r:−0,111, p<0,05).
Discussie
Resultaten van CO-FLOW tot 12 maanden na ziekenhuisontslag voor COVID-19 laten zien dat:
- 80% van de patiënten na ziekenhuisontslag een vorm van revalidatie kreeg, waarvan het merendeel in de eerste lijn, 15% werd behandeld in MSR en 14% in GRZ met een gemiddelde opnameduur van ruim één maand;
- patiënten die werden getriageerd naar MSR of GRZ een ernstiger ziektebeloop hadden dan mensen getriageerd naar 1e lijnsrevalidatiezorg of geen revalidatiezorg;
- er over het algemeen een goed herstel was in cardiorespiratoire fitheid en spierkracht, waarbij het herstel vooral optrad in de eerste zes maanden na ziekenhuisontslag. Vooral patiënten in MSR en GRZ hadden ernstige beperkingen in fitheid kort na ziekenhuisontslag, maar op 12 maanden was er geen significant verschil meer tussen de groepen met en zonder revalidatienazorg;
- 92% van de patiënten 12 maanden na ziekenhuisontslag nog één of meerdere klachten rapporteerde, naast vermoeidheid vooral (inspannings)dyspnoe, spierzwakte, en geheugen- en concentratieproblemen;
- op 12 maanden nog 21% van de patiënten lichte cognitieve stoornissen had, waarbij patiënten in MSR relatief weinig cognitieve stoornissen (MoCA: 11%) hadden, maar tussen drie en zes maanden na ziekenhuisontslag een toename lieten zien in cognitieve klachten (CFQ: 14% en 28% op drie en zes maanden, respectievelijk);
- psychische klachten in de loop van de tijd afnamen tot een prevalentie die overeenkomt met die in de algemene populatie,17,18 waarbij patiënten in MSR relatief vaak psychische klachten hadden.
Alhoewel cohorten lastig met elkaar te vergelijken zijn, sluit onze bevinding dat veel patiënten na ziekenhuisopname voor COVID-19 langdurig klachten ervaren, ook wel het post-COVID-19 syndroom19 genoemd, aan bij internationale onderzoeken.20-22 We moeten ons hierbij realiseren dat we het vóórkomen van zelfgerapporteerde klachten in CO-FLOW gemeten hebben met een niet-gevalideerde checklist en dat we de ernst van de klachten niet hebben uitgevraagd. Echter, onze bevinding dat op basis van een gevalideerde vragenlijst (FAS9) 60% van de patiënten substantiële vermoeidheid ervaart en dat dit niet verbetert over de tijd, is zorgwekkend. Dit geldt ook voor cognitieve status: gevalideerde meetinstrumenten (MoCA13 evenals CFQ14) toonden op 12 maanden na ziekenhuisontslag problemen aan bij ruim 20% van de patiënten. Het was opvallend dat de MSR-groep tussen drie en zes maanden een toename in cognitieve klachten liet zien en bovendien hadden patiënten in deze groep het vaakst psychische problemen. Mogelijk zou dit verklaard kunnen worden door de hogere eisen die aan hen gesteld worden na ontslag uit het revalidatiecentrum, zoals door hun gezinsleven en terugkeer naar werk. Cognitieve klachten zijn vaak ook geassocieerd met psychische klachten, dit vonden wij ook in onze studie, maar we vonden geen correlatie met cognitieve stoornissen.23 Aanvullende revalidatie, in de vorm van arbeidsbegeleiding en/of cognitieve/psychologische ondersteuning, zou mogelijk tot betere uitkomsten kunnen leiden.
Ten aanzien van het fysieke herstel ligt het anders. Zeker gezien het hoge percentage comorbiditeit, waaronder obesitas en cardiovasculaire aandoeningen (tabel 1), was het herstel van cardiorespiratoire fitheid (6MWT) en algehele spierkracht (HGS) over het algemeen goed. Het herstel gemeten met de 1MSTST bleef wat achter, waarschijnlijk omdat uitkomsten op deze test ook geassocieerd zijn met functionele spierkracht in de onderste extremiteiten,24 waarin mogelijk beperkingen persisteren zoals ook eerder is gevonden.25 Revalidatie lijkt een positieve bijdrage geleverd te hebben aan het fysieke herstel want op 12 maanden na ziekenhuisontslag was er geen significant verschil meer in fysieke status tussen de groepen met en zonder revalidatienazorg, terwijl kort na ziekenhuis-ontslag vooral patiënten in MSR en GRZ ernstige fitheidsbeperkingen hadden.
Limitaties
Een belangrijke limitatie is dat we de uitkomsten niet met pre-morbide niveaus kunnen vergelijken. Voor interpretatie van de uitkomsten hebben we gebruik gemaakt van normatieve waarden en prevalentiecijfers gebaseerd op de algehele bevolking. Door relatief hoge inclusie van Erasmus MC patiënten is het CO-FLOW-cohort niet representatief in het aandeel IC-opnames, 42% versus landelijk 15%.4 Dit geeft ons echter wel de mogelijkheid om in toekomstige analyses de rol van IC-opname in het herstel te evalueren.
Financiering
Het CO-FLOW onderzoek is mogelijk gemaakt door het COVID-19 Programma Zorg en Preventie van ZonMw (projectnummer 10430022010026) en een startfinanciering van Erasmus MC, Rijndam Revalidatie en zorginstelling Laurens.
Dankwoord
Graag willen we alle patiënten en deelnemende instellingen bedanken: Rijndam Revalidatie, zorginstelling Laurens, zorginstelling Aafje, Reinier de Graaf Gasthuis, Franciscus Gasthuis en Vlietland, Maasstad ziekenhuis, Ikazia Ziekenhuis, IJsselland Ziekenhuis, Albert Schweitzer Ziekenhuis.
CO-FLOW groep
Michel E. van Genderen, Jasper van Bommel, Diederik A.M.P.J. Gommers, Erwin Ista, Robert van der Stoep, Rutger Osterthun, Markus P.J.M. Wijffels, Marieke M. Visser, Janette J. Tazmi-Staal, Eva G. Willems, Roxane Heller, Shai A. Gajadin, Wouter J.B. Blox, Laurien Oswald, Sieshem Bindraban, Rob Slingerland, Herbert J. van de Sande, Ronald N. van Rossem, Stephanie van Loon-Kooij , L. Martine Bek, Julia C. Berentschot, Merel E. Hellemons, Joachim G.J.V. Aerts, Majanka H. Heijenbrok-Kal, Rita J.G. van den Berg-Emons, Gerard M. Ribbers.
Abstract
Background: The COVID-19 pandemic forced quick development of aftercare after hospitalization.
Aim: To evaluate aftercare, we assessed symptoms and physical, cognitive, and psychological recovery across different care pathways up to 12 months after hospital discharge.
Method: Multicenter prospective cohort study following 650 patients with COVID-19, treated in community-based rehabilitation (Com-rehab, 51%), medical rehabilitation (Med-rehab, 15%), skilled nursing facility (SNF-rehab, 14%) and without rehabilitation (No-rehab, 20%) with measurements at three, six, and 12 months after hospital discharge. Assessment of symptoms (Corona Symptom Checklist), cardiorespiratory fitness (6-minute walk distance [6MWD], 1-minute sit-to-stand test [1MSTST]), overall muscle strength (handgrip strength [HGS]), cognitive deficits (MoCA), cognitive failures (CFQ), posttraumatic stress disorder (PTSD: IES-R), and anxiety and depression (HADS).
Results: Patients in Med- and SNF-rehab had worse clinical characteristics (e.g. ICU admittance, longer length of hospital stay) than patients in other groups (p<0.001). At 12 months, 92% of patients had ≥1 persisting symptom; fatigue was prevalent in 60%. Percentage of normative values reached in 1MSTST differed (p<0.001) across care pathways at three months, with largest impairments in Med- and SNF-rehab; at 12 months there were no significant differences anymore between rehab and no-rehab groups. Overall, patients reached 91% on 6MWD, 75% on 1MSTST, and 107% on HGS. Cognitive deficits persisted at 12 months in 21%, cognitive failures in 22%, and 7% had PTSD, 11% anxiety, and 10% depressive symptoms.
Conclusion: The majority experienced sequelae up to 12 months after hospitalization. Rehabilitation seemed effective in physical recovery, but cognitive recovery lagged behind.
Keywords: COVID-19, symptoms, physical status, cognitive status, psychological status, rehabilitation aftercare
Referenties
- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review. Jama 2020;324(8):782-93.
- Ballering AV, van Zon SKR, olde Hartman TC, Rosmalen JGM. Persistence of somatic symptoms after COVID-19 in the Netherlands: an observational cohort study. Lancet 2022;400(10350):452-61.
- Evans RA, McAuley H, Harrison EM, Shikotra A, Singapuri A, Sereno M, et al. Physical, cognitive, and mental health impacts of COVID-19 after hospitalisation (PHOSP-COVID): a UK multicentre, prospective cohort study. Lancet Respir Med 2021;9(11):1275-87.
- NICE. National Intensive Care Evaluation: Stichting NICE; 2023 [updated 20 December 2022] [accessed on 21 February 2023]. Available from: https://www.stichting-nice.nl/covid-19-op-de-ic.jsp.
- Bek LM, Berentschot JC, Hellemons ME, Huijts SM, Aerts JGJV, van Bommel J, et al. CO-FLOW: COvid-19 Follow-up care paths and Long-term Outcomes Within the Dutch health care system: study protocol of a multicenter prospective cohort study following patients 2 years after hospital discharge. BMC health services research 2021;21(1):1-10.
- Bek LM, Berentschot JC, Heijenbrok-Kal MH, Huijts S, van Genderen ME, Vlake JH, et al. Symptoms persisting after hospitalization for COVID-19: 12 months interim results of the COFLOW study. ERJ Open Research 2022:00355-2022.
- Berentschot JC, Heijenbrok-Kal MH, Bek LM, Huijts SM, van Bommel J, van Genderen ME, et al. Physical recovery across care pathways up to 12 months after hospitalization for COVID-19: A multicenter prospective cohort study (CO-FLOW). Lancet Reg Health Eur 2022;22:100485.
- Bek LM, Hellemons ME, Berentschot JC, Visser MM, Huijts SM, van Bommel J, et al. Cognitive and psychological recovery patterns across different care pathways 12 months after hospitalization for COVID-19: A multicenter cohort study (CO-FLOW). Annals of Physical and Rehabilitation Medicine 2023;66(5):101737.
- Michielsen HJ, de Vries J, van Heck GL. Psychometric qualities of a brief self-rated fatigue measure: The Fatigue Assessment Scale. J Psychosom Res 2003;54(4):345-52.
- Enright PL, Sherrill DL. Reference equations for the six-minute walk in healthy adults. American journal of respiratory and critical care medicine 1998;158(5):1384-7.
- Strassmann A, Steurer-Stey C, Dalla Lana K, Zoller M, Turk AJ, Suter P, et al. Population-based reference values for the 1-min sit-to-stand test. International journal of public health 2013;58(6):949-53.
- Dodds RM, Syddall HE, Cooper R, Benzeval M, Deary IJ, Dennison EM, et al. Grip strength across the life course: normative data from twelve British studies. PloS one 2014;9(12):e113637.
- Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005;53(4):695-9.
- Broadbent DE, Cooper PF, FitzGerald P, Parkes KR. The Cognitive Failures Questionnaire (CFQ) and its correlates. Br J Clin Psychol 1982;21(1):1-16.
- Weiss DS, Marmar CR, Wilson JP, Keane TM. Assessing psychological trauma and PTSD. The Impact of Events Scale—Revised. 1997;19:399-411.
- Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983;67(6):361-70.
- De Graaf R, ten Have M, van Gool C, van Dorsselaer S. [Prevalence of mental disorders, and trends from 1996 to 2009. Results from NEMESIS-2] Prevalentie van psychische aandoeningen en trends van 1996 tot 2009; resultaten van NEMESIS-2. Tijdschr Psychiatr 2012;54(1):27-38.
- De Vries GJ, Olff M. The lifetime prevalence of traumatic events and posttraumatic stress disorder in the Netherlands. J Trauma Stress 2009;22(4):259-67.
- WHO. World Health Organistation. A clinical case definition of post COVID-19 condition by a Delphi consensus, 6 October 2021: WHO/2019-nCoV/Post_COVID-19_condition/Clinical_case_definition/2021.1; 2021 [updated 6 October 2021] [accessed on 02 January 2022]. Available from: https://www.who.int/publications/i/item/WHO-2019-nCoV-Post_COVID-19_condition-Clinical_case_definition-2021.1.
- Huang L, Yao Q, Gu X, Wang Q, Ren L, Wang Y, et al. 1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study. Lancet 2021;398(10302):747-58.
- Huang L, Li X, Gu X, Zhang H, Ren L, Guo L, et al. Health outcomes in people 2 years after surviving hospitalisation with COVID-19: a longitudinal cohort study. Lancet Respir Med 2022;10(9):863-76.
- Evans RA, Leavy OC, Richardson M, Elneima O, McAuley HJC, Shikotra A, et al. Clinical characteristics with inflammation profiling of long COVID and association with 1-year recovery following hospitalisation in the UK: a prospective observational study. Lancet Resp Med 2022;10(8):761-75.
- Gouraud C, Bottemanne H, Lahlou-Laforêt K, Blanchard A, Günther S, Batti SE, et al. Association Between Psychological Distress, Cognitive Complaints, and Neuropsychological Status After a Severe COVID-19 Episode: A Cross-Sectional Study. Front Psychiatry 2021;12:725861.
- Bohannon RW, Crouch R. 1-Minute Sit-to-Stand Test: SYSTEMATIC REVIEW OF PROCEDURES, PERFORMANCE, AND CLINIMETRIC PROPERTIES. Journal of Cardiopulmonary Rehabilitation and Prevention 2019;39(1):2-8.
- Lorent N, Weygaerde YV, Claeys E, Caamano Fajardo IG, de Vos N, de Wever W, et al. Prospective longitudinal evaluation of hospitalised COVID-19 survivors 3 and 12 months after discharge. ERJ Open Research 2022:00004-2022.
Gerelateerde artikelen NTR
Patiënten met post-COVID syndroom worden zieker van inspanning
Nazorg en langetermijngevolgen van COVID-19; interim-analyses tot 12 maanden na ziekenhuisontslag in het CO-FLOW cohort

Post-COVID syndroom bij kinderen: klachten en behandelstrategieën

Persoonsgerichte, integrale nazorg voor het post-COVID syndroom
Gerelateerde artikelen Revalidatie Magazine

Vernieuwde aanpak voor revalidatie na IC-opname

Post-COVID-patiënt lijkt op te knappen van rustige revalidatie